[UTIlização prevista]
O Teste Rápido de Troponina I (cTnI) (sangue integral/ soro/ plasma) é um imunotest visual rápido para a detecção qualitativa e presuntiva da troponina cardíaca I no sangue integral humano,amostras de soro ou plasmaÉ destinado a ser utilizado como auxílio no diagnóstico de infarto do miocárdio (IM).
[INTRODUÇÃO]
A troponina cardíaca I (cTnI) é uma proteína encontrada no músculo cardíaco com um peso molecular de 22,5 kDa.Junto com a tropomiosinaEste complexo estrutural constitui o principal componente que regula a actividade da ATPase sensível ao cálcio da actomiosina no músculo esquelético estriado e no músculo cardíaco.A troponina I é liberada no sangue 4-6 horas após o início da dorO padrão de liberação de cTnI é semelhante ao de CK-MB, mas enquanto os níveis de CK-MB voltam ao normal após 72 horas, a troponina I permanece elevada durante 6 a 10 dias,permitindo assim uma janela mais longa de detecção de lesões cardíacasA elevada especificidade das medições cTnI para a identificação de lesões do miocárdio foi demonstrada em condições como o período perioperatório, após corridas de maratona,e trauma torácico contundente. a liberação de cTnI também foi documentada em doenças cardíacas diferentes do infarto agudo do miocárdio (AMI), tais como angina instável, insuficiência cardíaca congestiva,e danos isquêmicos devido à cirurgia de bypass da artéria coronarianaDevido à sua elevada especificidade e sensibilidade no tecido do miocárdio, a troponina I tornou- se recentemente o biomarcador preferido para o infarto do miocárdio.
[CONTENUDO PRINCIPAL]
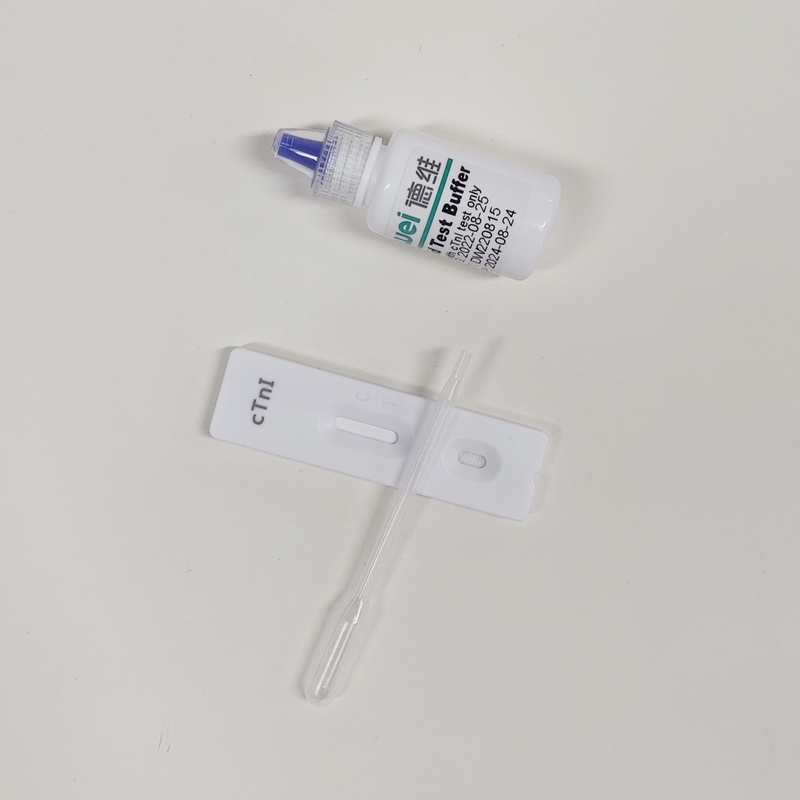
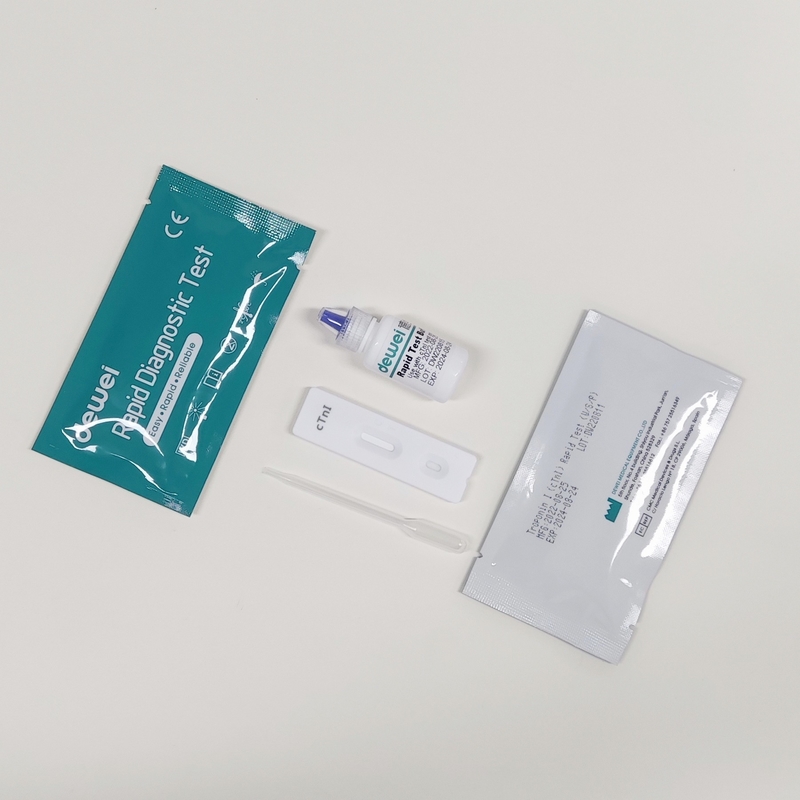
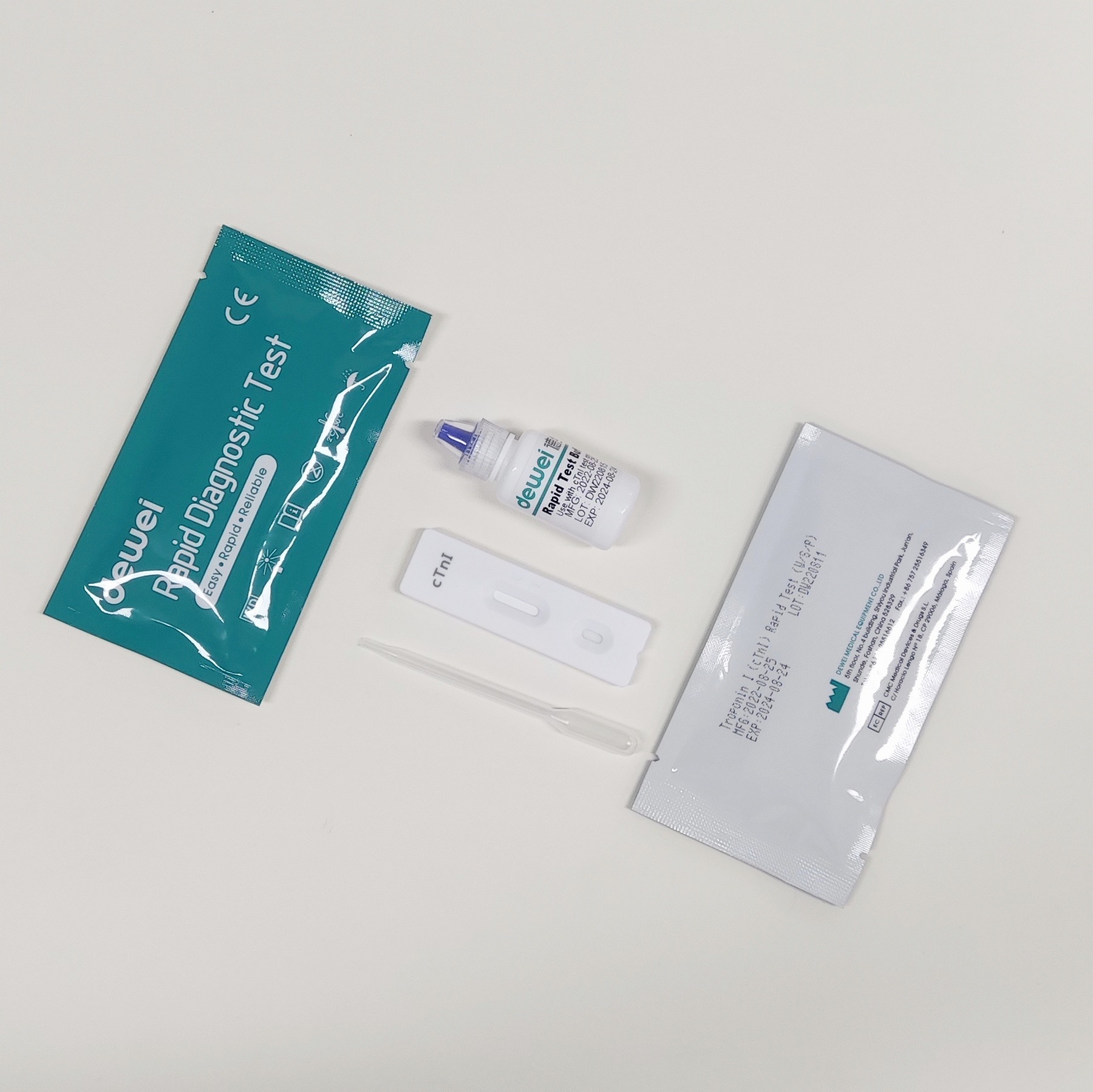
• Caixa de ensaio rápido com dessecante
• Pipetas descartáveis
• Reservatório
• Folheto informativo
[PREVENÇÕES]
• Apenas para utilização profissional de diagnóstico in vitro.
• Não utilize após a data de validade indicada na embalagem.
• Este kit contém produtos de origem animal. O conhecimento certificado da origem e/ou do estado sanitário dos animais não garante completamente a ausência de agentes patogénicos transmissíveis.É, portanto,, recomendou que estes produtos fossem tratados como potencialmente infecciosos e manuseados observando as precauções de segurança habituais (por exemplo, não ingerir ou inhalar).
• Evitar a contaminação cruzada das amostras utilizando um novo recipiente de recolha de amostras para cada amostra obtida.
• Leia atentamente todo o procedimento antes do ensaio.
• Não coma, beba ou fume na área onde as amostras e os kits são manuseados.Observar as precauções estabelecidas contra os perigos microbiológicos durante todo o procedimento e seguir os procedimentos normalizados para a eliminação adequada das amostras. Usar vestuário de protecção, tais como casacos de laboratório, luvas descartáveis e protecção ocular quando as amostras são analisadas.
• A humidade e a temperatura podem afetar negativamente os resultados.
• Os materiais de ensaio utilizados devem ser descartados de acordo com as normas locais.
[ARMAZEMENTO E ESTABILIDADE]
• Conservar a 2 ~ 30oC na bolsa selada durante 24 meses.
• Manter longe da luz solar direta, da humidade e do calor
• NÃO congele.
[Colecção de amostras]
• O Teste Rápido Troponina I (cTnI) destina- se a ser utilizado apenas com amostras de sangue humano integral, soro ou plasma.
O soro ou plasma devem ser separados o mais rapidamente possível para evitar a hemólise.
• Realizar o ensaio imediatamente após a recolha da amostra. Não deixar as amostras a temperatura ambiente durante períodos prolongados. As amostras de soro e plasma podem ser armazenadas a 2- 8°C durante um máximo de 3 dias.Para armazenagem a longo prazoO sangue inteiro colhido por punção venosa deve ser armazenado a 2- 8°C se o teste for executado no prazo de 2 dias após a colheita.O sangue inteiro recolhido por punhal deve ser examinado imediatamente.
• Para armazenamento de sangue inteiro devem ser utilizados recipientes que contenham anticoagulantes como EDTA, citrato ou heparina.
•Aprovar a temperatura ambiente das amostras antes do ensaio. As amostras congeladas devem ser completamente descongeladas e bem misturadas antes do ensaio. Evitar o congelamento e descongelamento repetidos das amostras.
•Se os espécimes forem enviados, embalar em conformidade com todas as regulamentações aplicáveis ao transporte de agentes etiológicos. •Ictéricos, lipémicos, hemolisados,As amostras tratadas termicamente e contaminadas podem causar resultados errôneos..
• Existe uma ligeira possibilidade de que algumas amostras de sangue inteiro com viscosidade muito elevada ou que tenham sido armazenadas durante mais de 2 dias não funcionem adequadamente no dispositivo de ensaio.Repetir o ensaio com uma amostra de soro ou plasma do mesmo doente utilizando um novo dispositivo de ensaio.
[Direcção de utilização]
Colocar os ensaios, amostras, amortecedores e/ou controles à temperatura ambiente (15-30°C) antes da utilização.
1. Retire o ensaio da bolsa selada e coloque- o numa superfície lisa e limpa.O ensaio deve ser realizado no prazo de uma hora..
2Transferir 1 gota de amostra de sangue, soro ou plasma inteiro para o poço de amostra (S) do dispositivo com a pipeta descartável fornecida, depois adicionar 1 gota de tampão e iniciar o temporizador.Evitar a captura de bolhas de ar no poço da amostra (S), e não adicionar qualquer solução para a janela de resultado.
3. Espere que as faixas coloridas apareçam. O resultado deve ser lido dentro de 15 minutos. Não interprete o resultado após 20 minutos.
[Interpretação dos resultados]
POSITIVO: A presença de duas linhas como linha de controlo (C) e linha de ensaio (T) na janela de resultados indica um resultado positivo.
NEGATIVO: A presença de apenas uma linha de controlo (C) na janela de resultados indica um resultado negativo.Se a linha de controlo (C) não for visível na janela de resultados após a realização do ensaioAlgumas causas de resultados inválidos são devido a não seguir as instruções corretamente ou o teste pode ter-se deteriorado após a data de validade.Recomenda-se que a amostra seja reexaminada utilizando um novo ensaio..
[CONTROLO DA QUALIDADE]
• Os controles internos de procedimento são incluídos no ensaio.que confirme o volume suficiente de amostras e a técnica procedimental correta.
• Os comandos externos não são fornecidos com este kit.Recomenda-se que os controlos positivos e negativos sejam testados como boa prática de laboratório para confirmar o procedimento de ensaio e verificar o correcto desempenho dos ensaios..
[Limitações]
1O Teste Rápido cTnI destina-se a um uso profissional de diagnóstico in vitro e só deve ser utilizado para a detecção qualitativa da troponina cardíaca I.Nenhum significado deve ser deduzido da intensidade de cor ou largura de quaisquer faixas aparentes.
2O teste cTnI rápido indicará apenas a presença de troponina na amostra e não deve ser utilizado como único critério para o diagnóstico de infarto do miocárdio.
3Se o resultado do teste for negativo e os sintomas clínicos persistirem, recomenda-se um ensaio adicional utilizando outros métodos clínicos.um resultado negativo não exclui a existência de troponina I no sangue, porque os anticorpos podem estar ausentes ou abaixo do nível mínimo de detecção do teste.
4Tal como acontece com todos os testes de diagnóstico, um diagnóstico confirmado só deve ser feito por um médico após a avaliação de todos os resultados clínicos e laboratoriais.
5Alguns espécimes que contêm títulos anormalmente elevados de anticorpos heterófilos com fator reumatoide (RF) podem afectar os resultados esperados.A avaliação clínica adicional deve ser considerada com outras informações clínicas disponíveis para o médico..
[Características de desempenho]
Sensibilidade relativa: 99,45%
Especificidade relativa: 99,52%
Acordos gerais: 99,49%

 Por favor verifique seu email!
Por favor verifique seu email! Por favor verifique seu email!
Por favor verifique seu email!  Por favor verifique seu email!
Por favor verifique seu email! Por favor verifique seu email!
Por favor verifique seu email!